- ALDOLS ET CÉTOLS
- ALDOLS ET CÉTOLSAldols et cétols sont les composés dont la chaîne hydrocarbonée porte à la fois une fonction alcool et une fonction carbonyle, aldéhyde ou cétone.C’est Charles Adolphe Wurtz qui a donné le nom d’aldol (de ald éhyde-alcool ) au composé résultant de la dimérisation de l’acétaldéhyde:
 Ce nom est devenu générique pour désigner les aldéhydes-alcools.L’aldol de Wurtz est un intermédiaire important de la synthèse industrielle de molécules linéaires fonctionnelles en C4: n -butanol, acide butyrique, autrefois butadiène.Parmi les céto-alcools, les 廓-cétols résultant de la dimérisation de cétones énolisables sont les plus importants, notamment le «diacétone alcool» issu de l’acétone:
Ce nom est devenu générique pour désigner les aldéhydes-alcools.L’aldol de Wurtz est un intermédiaire important de la synthèse industrielle de molécules linéaires fonctionnelles en C4: n -butanol, acide butyrique, autrefois butadiène.Parmi les céto-alcools, les 廓-cétols résultant de la dimérisation de cétones énolisables sont les plus importants, notamment le «diacétone alcool» issu de l’acétone: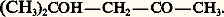 C’est un intermédiaire de la synthèse de deux solvants industriels: la méthylisobutylcétone et le méthylisobutylcarbinol.Les sucres sont des aldo- et des céto-polyols.1. NomenclatureLe nom des aldols et des cétols est formé au moyen des suffixes ol-al et ol-one précédés des numéros correspondant à leur position sur la chaîne. On distingue aussi les 見-, 廓-, 塚-, ... aldols et cétols en fonction de la position relative des deux groupements fonctionnels.2. Préparations size=5見-aldols et cétolsL’hydrolyse directe des aldéhydes et cétones 見-halogénés, d’accès facile, ne convient pas: on les transforme d’abord en acétates qu’on hydrolyse ou alcoolyse ensuite:
C’est un intermédiaire de la synthèse de deux solvants industriels: la méthylisobutylcétone et le méthylisobutylcarbinol.Les sucres sont des aldo- et des céto-polyols.1. NomenclatureLe nom des aldols et des cétols est formé au moyen des suffixes ol-al et ol-one précédés des numéros correspondant à leur position sur la chaîne. On distingue aussi les 見-, 廓-, 塚-, ... aldols et cétols en fonction de la position relative des deux groupements fonctionnels.2. Préparations size=5見-aldols et cétolsL’hydrolyse directe des aldéhydes et cétones 見-halogénés, d’accès facile, ne convient pas: on les transforme d’abord en acétates qu’on hydrolyse ou alcoolyse ensuite: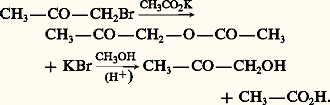 L’hydratation d’un alcool 見-acétylénique, facilement obtenu par éthynylation d’un aldéhyde ou d’une cétone, conduit à un 見-cétol:
L’hydratation d’un alcool 見-acétylénique, facilement obtenu par éthynylation d’un aldéhyde ou d’une cétone, conduit à un 見-cétol: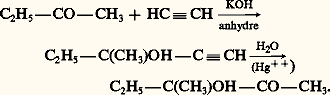 Les acyloïnes aromatiques Ar-CHOH-CO-Ar sont obtenues par condensation d’un aldéhyde sous l’action catalytique du cyanure de potassium (réaction 1). En série aliphatique, ce sont les esters que l’on condense en présence de sodium; il se forme le sel disodique d’un énediol qui, hydrolysé, s’isomérise en 見-cétol:
Les acyloïnes aromatiques Ar-CHOH-CO-Ar sont obtenues par condensation d’un aldéhyde sous l’action catalytique du cyanure de potassium (réaction 1). En série aliphatique, ce sont les esters que l’on condense en présence de sodium; il se forme le sel disodique d’un énediol qui, hydrolysé, s’isomérise en 見-cétol: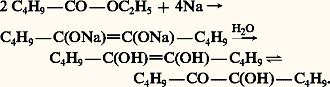 L’aldéhyde glycolique est préparé industriellement par oxydation ménagée du glycol:
L’aldéhyde glycolique est préparé industriellement par oxydation ménagée du glycol: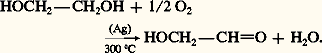 size=5廓-aldols et cétolsLes 廓-aldols résultent de l’action, sur les aldéhydes énolisables, de bases moyennement fortes comme KCN, Na2C3 ou NaOH diluée:
size=5廓-aldols et cétolsLes 廓-aldols résultent de l’action, sur les aldéhydes énolisables, de bases moyennement fortes comme KCN, Na2C3 ou NaOH diluée: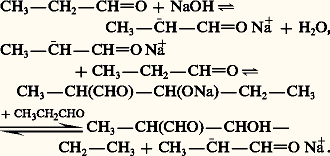 L’ensemble des réactions est réversible et l’équilibre est largement déplacé vers la formation de l’aldol. Cette aldolisation peut être également catalysée par les acides: mais, résistant mal à ce milieu, les aldols tendent à se déshydrater en aldéhydes 見-éthyléniques.Des bases plus fortes, comme la potasse alcoolique, provoquent une répétition de l’aldolisation qui conduit à des produits lourds de polycondensation.L’aldolisation mixte résulte de la réaction de condensation, dans les mêmes conditions, de deux aldéhydes, l’un énolisable et l’autre non. Le premier est transformé par la base catalyseur en énolate nucléophile qui attaque la fonction carbonyle du second:
L’ensemble des réactions est réversible et l’équilibre est largement déplacé vers la formation de l’aldol. Cette aldolisation peut être également catalysée par les acides: mais, résistant mal à ce milieu, les aldols tendent à se déshydrater en aldéhydes 見-éthyléniques.Des bases plus fortes, comme la potasse alcoolique, provoquent une répétition de l’aldolisation qui conduit à des produits lourds de polycondensation.L’aldolisation mixte résulte de la réaction de condensation, dans les mêmes conditions, de deux aldéhydes, l’un énolisable et l’autre non. Le premier est transformé par la base catalyseur en énolate nucléophile qui attaque la fonction carbonyle du second: La réaction d’hydroxyméthylation de l’acétaldéhyde peut se produire au niveau des trois hydrogènes énolisables et conduire au trihydroxyméthylacétaldéhyde qui, réagissant avec une quatrième molécule de méthanol, selon un processus de dismutation de Cannizaro, conduit à un tétraalcool primaire, le pentaérythritol:
La réaction d’hydroxyméthylation de l’acétaldéhyde peut se produire au niveau des trois hydrogènes énolisables et conduire au trihydroxyméthylacétaldéhyde qui, réagissant avec une quatrième molécule de méthanol, selon un processus de dismutation de Cannizaro, conduit à un tétraalcool primaire, le pentaérythritol: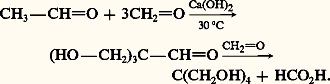 Celui-ci est utilisé pour la fabrication de résines alkyde, matières premières de l’industrie des peintures; le tétranitrate est employé comme explosif, et les esters d’acides gras supérieurs servent d’additifs pour huiles, de plastifiants et d’émulgateurs.Les 廓-cétols se forment, dans des réactions comparables, à partir de cétones énolisables seules ou en mélange avec des aldéhydes:
Celui-ci est utilisé pour la fabrication de résines alkyde, matières premières de l’industrie des peintures; le tétranitrate est employé comme explosif, et les esters d’acides gras supérieurs servent d’additifs pour huiles, de plastifiants et d’émulgateurs.Les 廓-cétols se forment, dans des réactions comparables, à partir de cétones énolisables seules ou en mélange avec des aldéhydes: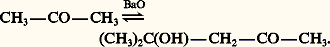 L’ensemble des réactions est réversible mais, à la différence de l’aldolisation, l’équilibre correspond à une très faible concentration en cétol, de sorte que, pour produire ce dernier, il doit être déplacé. Le diacétone alcool se prépare généralement en mettant en contact l’acétone et le catalyseur solide oxyde de baryum: l’acétone est portée à ébullition dans un ballon surmonté d’un Soxhlet dont la cartouche renferme la baryte. La condensation se réalise au contact du catalyseur et le liquide qui retombe dans le ballon contient d’abord de faibles quantités de cétol, puis il s’enrichit lentement; en effet, en l’absence de catalyseur dans le ballon, la réaction inverse de rétrocétolisation ne se produit pas. Quand la teneur en cétol avoisine 30 p. 100, on chasse l’acétone en excès sous pression réduite.Lors de la cétolisation mixte entre aldéhyde et cétone, de faibles quantités de ces deux composés sont réversiblement transformées en énolates. Chacun de ces derniers, réactifs nucléophiles, peut attaquer, réversiblement, soit l’aldéhyde, soit la cétone: du fait de l’équilibre défavorable de la réaction d’une cétone sur un énolate, la condensation résulte de l’attaque de l’aldéhyde par celui de la cétone et le produit obtenu est le 廓-cétol (réaction de Claisen-Schmidt) [réaction 2]. Une étape importante de la synthèse industrielle de la vitamine A fait intervenir la condensation de l’acétone et de l’aldéhyde géranial: le 廓-cétol formé se déshydrate spontanément pour donner la pseudo-ionone (réaction 3).3. PropriétésLes aldols et les cétols sont des liquides visqueux dont les premiers termes sont solubles dans l’eau. Ils sont à peine distillables sous pression réduite sans décomposition.Les 見-cétols, notamment les acyloïnes, se dimérisent réversiblement (hémiacétalisation) en dioxannes-1,4 instables (réaction 4). Ils réagissent avec l’urée pour former des imidazolinones-2 (réaction 5). Ce sont des réducteurs comme le montre leur action sur le nitrate d’argent ammoniacal et la liqueur de Fehling; ils sont facilement oxydés en 見-dicétones (réaction 6). L’acide métapériodique les scinde en un aldéhyde et un acide:
L’ensemble des réactions est réversible mais, à la différence de l’aldolisation, l’équilibre correspond à une très faible concentration en cétol, de sorte que, pour produire ce dernier, il doit être déplacé. Le diacétone alcool se prépare généralement en mettant en contact l’acétone et le catalyseur solide oxyde de baryum: l’acétone est portée à ébullition dans un ballon surmonté d’un Soxhlet dont la cartouche renferme la baryte. La condensation se réalise au contact du catalyseur et le liquide qui retombe dans le ballon contient d’abord de faibles quantités de cétol, puis il s’enrichit lentement; en effet, en l’absence de catalyseur dans le ballon, la réaction inverse de rétrocétolisation ne se produit pas. Quand la teneur en cétol avoisine 30 p. 100, on chasse l’acétone en excès sous pression réduite.Lors de la cétolisation mixte entre aldéhyde et cétone, de faibles quantités de ces deux composés sont réversiblement transformées en énolates. Chacun de ces derniers, réactifs nucléophiles, peut attaquer, réversiblement, soit l’aldéhyde, soit la cétone: du fait de l’équilibre défavorable de la réaction d’une cétone sur un énolate, la condensation résulte de l’attaque de l’aldéhyde par celui de la cétone et le produit obtenu est le 廓-cétol (réaction de Claisen-Schmidt) [réaction 2]. Une étape importante de la synthèse industrielle de la vitamine A fait intervenir la condensation de l’acétone et de l’aldéhyde géranial: le 廓-cétol formé se déshydrate spontanément pour donner la pseudo-ionone (réaction 3).3. PropriétésLes aldols et les cétols sont des liquides visqueux dont les premiers termes sont solubles dans l’eau. Ils sont à peine distillables sous pression réduite sans décomposition.Les 見-cétols, notamment les acyloïnes, se dimérisent réversiblement (hémiacétalisation) en dioxannes-1,4 instables (réaction 4). Ils réagissent avec l’urée pour former des imidazolinones-2 (réaction 5). Ce sont des réducteurs comme le montre leur action sur le nitrate d’argent ammoniacal et la liqueur de Fehling; ils sont facilement oxydés en 見-dicétones (réaction 6). L’acide métapériodique les scinde en un aldéhyde et un acide: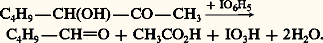 En milieu alcalin, les 見-aldols s’isomérisent réversiblement en 見-cétols, par l’intermédiaire d’un énediol:
En milieu alcalin, les 見-aldols s’isomérisent réversiblement en 見-cétols, par l’intermédiaire d’un énediol: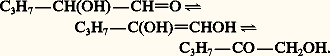 Le 廓-aldol de Wurtz est trimérisé à froid par l’acide sulfurique concentré en paraldol. Ce polymère, cristallisé, est sous sa forme de conservation; il se comporte, vis-à-vis des acides, comme le monomère.Une propriété importante, commune aux 廓-aldols et 廓-cétols, est leur facile déshydratation par chauffage, en catalyse acide. L’aldéhyde ou la cétone 見-éthylénique qui en résultent sont stabilisés par la conjugaison. L’aldol de Wurtz se déshydrate par simple chauffage, en présence d’une petite quantité d’acide acétique, pour former l’aldéhyde crotonique, mélange d’isomères E et Z, qui a donné son nom à l’ensemble des deux réactions d’aldolisation et d’élimination qui est appelé crotonisation:
Le 廓-aldol de Wurtz est trimérisé à froid par l’acide sulfurique concentré en paraldol. Ce polymère, cristallisé, est sous sa forme de conservation; il se comporte, vis-à-vis des acides, comme le monomère.Une propriété importante, commune aux 廓-aldols et 廓-cétols, est leur facile déshydratation par chauffage, en catalyse acide. L’aldéhyde ou la cétone 見-éthylénique qui en résultent sont stabilisés par la conjugaison. L’aldol de Wurtz se déshydrate par simple chauffage, en présence d’une petite quantité d’acide acétique, pour former l’aldéhyde crotonique, mélange d’isomères E et Z, qui a donné son nom à l’ensemble des deux réactions d’aldolisation et d’élimination qui est appelé crotonisation: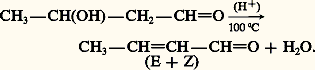 La crotonisation des 廓-cétols se produit encore plus facilement lorsque la fonction alcool est tertiaire: le diacétone alcool, chauffé en présence d’une trace d’acide sulfurique, donne la cétone 見-éthylénique, appelée improprement oxyde de mésityle, mélange de deux isomères dans lequel la forme conjuguée prédomine largement (réaction 7).L’oxyde de mésityle est un intermédiaire industriel important, qui, par hydrogénation sur palladium, conduit à la méthylisobutylcétone et, sur nickel à 150 0C, au méthylisobutylcarbinol. Ces deux produits sont des solvants de l’industrie des peintures (réactions 8).La double crotonisation de l’acétone est réalisée par simple chauffage en présence d’acide chlorhydrique sec; la cétone 見-, 見 -diéthylénique obtenue est encore appelée phorone (réaction 9).Par chauffage prolongé à 200 0C, sous pression, de l’acétone en présence d’une faible quantité de soude, il se forme successivement le diacétone alcool qui se déshydrate en oxyde de mésityle; celui-là réagit, dans une addition de Michael, avec une troisième molécule d’acétone (énolate) pour donner une 3,5,5-triméthylcyclohexène-2-one, isomère cyclique de la phorone et appelée isophorone (réaction 10).Un important alcool primaire industriel, le 2-éthylhexanol, est fabriqué par hydrogénation du 2-éthylhexèn-2-al, lui-même obtenu par crotonisation du butanal (réaction 11).
La crotonisation des 廓-cétols se produit encore plus facilement lorsque la fonction alcool est tertiaire: le diacétone alcool, chauffé en présence d’une trace d’acide sulfurique, donne la cétone 見-éthylénique, appelée improprement oxyde de mésityle, mélange de deux isomères dans lequel la forme conjuguée prédomine largement (réaction 7).L’oxyde de mésityle est un intermédiaire industriel important, qui, par hydrogénation sur palladium, conduit à la méthylisobutylcétone et, sur nickel à 150 0C, au méthylisobutylcarbinol. Ces deux produits sont des solvants de l’industrie des peintures (réactions 8).La double crotonisation de l’acétone est réalisée par simple chauffage en présence d’acide chlorhydrique sec; la cétone 見-, 見 -diéthylénique obtenue est encore appelée phorone (réaction 9).Par chauffage prolongé à 200 0C, sous pression, de l’acétone en présence d’une faible quantité de soude, il se forme successivement le diacétone alcool qui se déshydrate en oxyde de mésityle; celui-là réagit, dans une addition de Michael, avec une troisième molécule d’acétone (énolate) pour donner une 3,5,5-triméthylcyclohexène-2-one, isomère cyclique de la phorone et appelée isophorone (réaction 10).Un important alcool primaire industriel, le 2-éthylhexanol, est fabriqué par hydrogénation du 2-éthylhexèn-2-al, lui-même obtenu par crotonisation du butanal (réaction 11).
Encyclopédie Universelle. 2012.
